基于CISe@ZnS新型近紅外二區量子點生物探針研究進展
近紅外二區發光(950-1700 nm)在生物體內散射低、組織穿透深且成像分辨率高,在分析化學和生物醫學等領域具有非常重要的應用前景。特別地,近紅外二區無機量子點由于發射波長可調、吸收截面大和量子產率高等特性受到了國內外學者的廣泛關注。目前主要研究的近紅外二區量子點為II-VI族和IV-VI族半導體材料,如CdSe、CdTe和PbSe等,其中含有的重金屬元素(如Cd2+和Pb2+等)較大地限制了其后續的生物醫學應用。因此,開發具有良好生物相容性且**發光的近紅外二區量子點是目前生物標記領域的研究熱點和難點。
有課題組開發出CuInSe2(CISe)基新型**近紅外二區發光量子點生物探針,并首次將其應用于循環**細胞(CTC)檢測和**靶向實時成像(圖1)。該團隊通過**設計材料中的Se/In組分比,將CISe的發射峰位置由常規的920 nm調控至近紅外二區1224 nm;所合成量子點的激發譜可覆蓋紫外到近紅外(350-820 nm)的寬帶范圍,在實際應用中可適用于多種波長的激發光源。包覆ZnS殼層后,CISe的穩定性得以**提升,且在808 nm激發下其近紅外二區發光絕對量子產率高達21.8%,為目前已報道無毒近紅外二區量子點的較高值。
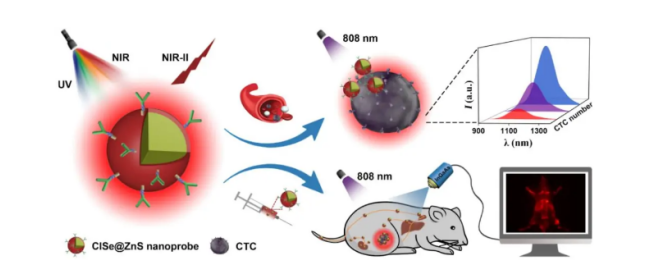
圖1、基于CISe@ZnS新型近紅外二區量子點生物探針的血液循環**細胞檢測和**靶向實時成像示意圖
進一步地,通過連接抗表皮細胞粘附分子(EpCAM)抗體,團隊利用CISe@ZnS探針可以實現對CTC(如人類****MCF-7細胞)的特異性識別,對血液樣本中CTC的檢測限可低至12個細胞/96孔(200 μL)。此外,團隊還將CISe@ZnS基近紅外二區發光探針應用于活體小鼠體內的**靶向實時成像,主要的器官和血管清晰可見,血管分辨率低至0.36 mm,信噪比高達5.8(圖2)。值得注意的是,該探針在尾靜脈注射4小時后即可通過腎通道和肝通道排出體外,展現出良好的生物相容性和易于代謝的優勢。
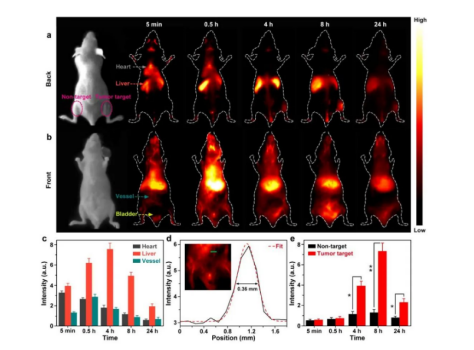
圖2、活體小鼠a)背部和b)腹部明場像,以及靜脈注射CISe@ZnS探針后的近紅外二區成像圖;c)注入探針后不同部位的發光強度變化;d)血管成像的分辨率;e)注入探針后**部位和非**部位發光強度變化
在近紅外二區發光生物探針的設計、合成及應用中已取得系列重要進展。例如,發展了**NaCeF4:Yb,Er近紅外二區發光納米探針,實現對人體血清中尿酸的高靈敏檢測及對活體小鼠組織的高分辨成像;研制了一種可用藍光LED激發的CaS:Ce,Er近紅外二區發光納米探針,實現對人體血清黃嘌呤的特異性體外檢測;設計合成了氧化石墨烯包覆的稀土納米探針NaYF4:Yb,Er@NaYF4@GO,實現了**細胞內microRNA可視化成像及**靶向的無背景近紅外二區成像。
定制產品:
紅外光量子點
近紅外熒光量子點:
近紅外熒光量子點(Near-infrared fluorescent quantum dots,NIRF-QDs)
發射波長為800 nm近紅外熒光量子點
多波長近紅外熒光量子點
近紅外發光量子點DMPS-CdTeQDs
L-半胱氨酸(L-Cys)的比例,在水相快速合成了近紅外CdTe量子點
Ag2S近紅外量子點
三元CdxPb1-xSe量子點
肽段連接的近紅外熒光量子點(QDs)
近紅外熒光量子點標記的羥基磷灰石
近紅外發光的Ag2S、Ag2Se或Ag2Te量子點
近紅外發光Ag2S-CdS核殼結構水溶性量子點
紅外量子點CdTe
近紅外1400~1650 nm的硫化鉛(PbS)量子點摻雜光子晶體光纖(QD-PCF)
紅外**的InAs量子點
紅光Sn量子點
近紅外量子點InP/ZnS
CdSe/ZnSe紅外量子點
近紅外PbS量子點
近紅外熒光Ag2S量子點
水溶性CdTe/CdS近紅外量子點
氮摻雜碳酸氧鉍(N-Bi_2O_2CO_3,N-BOC)/硒化鎘量子點(CdSeQDs)
PbSe量子點近紅外量子點
Ag摻雜HgS量子點
pH調諧的近紅外量子點(Ag摻雜HgS)
CdTe的II型水溶性近紅外量子點
**、水溶性、Ⅱ型CdTe/CdSe核殼近紅外量子點
CdTe/CdS@ZnS-SiO2近紅外量子點
CdTe/CdS/ZnS近紅外量子點
CdTe/CdS小核厚殼近紅外量子點
小編zhn2021.03.30




 齊岳微信公眾號
齊岳微信公眾號 官方微信
官方微信 庫存查詢
庫存查詢