外泌體介導的基因遞送研究
遞送對于基因**至關重要。細胞膜對帶負電的核酸設置不可滲透的屏障。而且,遺傳物質在人體內很脆弱,因此必須加以保護才能生效。mRNA和病毒或非病毒質粒DNA通常是基因**中使用的遺傳物質。例如,腺相關病毒(AAV)載體得到了廣泛使用。
然而,AAV載體誘導宿主免疫反應,導致載體快速降解或中和,并嚴重損害了其基因**的效率。納米結構(如外泌體)的封裝可保護AAV載體免受宿主免疫系統的侵害,并通過質膜將其遞送到細胞中。香港中文大學夏江教授等在Nanoscale雜志發表綜述,描述了外泌體作為載體進行封裝和將基因載體遞送至細胞的過程以及相關的疾病**方法(圖1)。外泌體作為各種遺傳物質的載體的利弊,工程化外泌體以增加負載和遞送的策略,大化基因負載外泌體產量的方法,以及對外泌體介導的靶向基因**的未來展望討論。
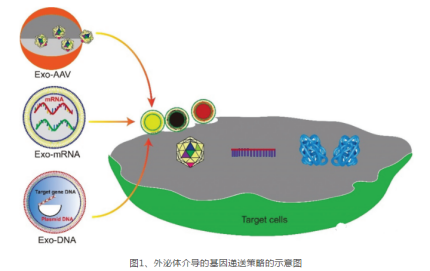
外泌體相關AAV載體用于基因**
根據來源,基因遞送載體可分為病毒系統或非病毒系統(圖2)。病毒介導的基因遞送系統使用復制缺陷的修飾病毒,但可以傳遞DNA表達,包括腺病毒、逆轉錄病毒和慢病毒。傳統的非病毒載體包括膠束、脂質體、樹狀聚合物和碳納米管。近,由細胞分泌的細胞外囊泡,特別是外泌體,已被用作基因遞送的非病毒載體,并顯示出高生物相容性、低清除率和適合細胞靶向傳遞的特性。雜合基因遞送技術,如外泌體-AAV雜交等,將病毒載體與非病毒載體結合使用,并顯示出**降低的免疫原性。該文重點探討基于病毒囊泡和外泌體的基因遞送載體。
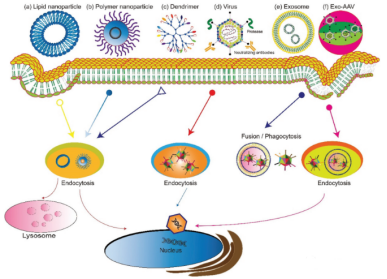
圖2、基因遞送載體概述
外泌體用于基因遞送
外泌體是直徑為40-160 nm的脂質雙層包裹的囊泡,在細胞外環境中循環。它們起源于晚期內體膜的內部出芽,并且被所有細胞類型釋放。因此,外泌體是細胞間通訊的天然載體。然后,此功能誘使開發基于外泌體的**遞送系統。與其他基因遞送系統相比,由于以下原因,外泌體是有利的。外泌體是多功能載體。外泌體可以包裹并遞送各種生物貨物,例如小RNA、mRNA和蛋白質。**,外泌體具有穿越生物屏障(例如血腦屏障)的天然能力。它們也可以遷移到沒有血液供應的組織或區域,例如致密的軟骨基質。此外,在到達目標組織后,外泌體可以在那里停留很長一段時間。清除率低歸因于外泌體的生物相容性。另一個重要特征是外泌體可以基因工程改造。通過改造外泌體的表面蛋白可以實現多種目的,例如,可以將靶向細胞或組織的肽附加在外泌體的表面上,以實現針對特定組織的選擇性靶向,避免在其他器官中不必要的積累,從而降低全身毒性。研究表明,基于外泌體的靶向基因療法可以增強**功效和安全性。
外泌體相關AAV用于基因**
與外泌體的結合可以減輕毒性并減輕AAV載體的快速清除。AAV載體具有諸如中和體內抗AAV抗體的快速清除和脫靶遞送(通常到肝臟)的缺點。在電子顯微鏡下,AAV衣殼與微囊泡的表面和內部締合。從細胞培養基中純化的與外泌體相關的AAV(Exo-AAV)(圖3)在轉導效率方面優于常規純化的AAV載體。AAV載體的一個**問題是,它會誘導強效的長期體液應答,包括與AAV載體結合并**轉導的中和抗體(NAb)和標記病毒的非Nabs。因此,NAb會對AAV介導的基因**的功效以及AAV載體的分布和安全性產生不利影響。相比之下,與傳統AAV相比,exo-AAV對中和抗AAV抗體的抵抗力更高。這已經被實驗證明。在體外和體內,與外泌體相關的AAV載體對NAb的抵抗力均高于AAV,在存在和不存在Nabs的情況下,AAV9Exo-SERCA2a在駐留心臟功能方面均優于常規AAV載體。Exo-AAV8基因的遞送降低了**劑量,并實現了**的轉導。Exo-AAV在中樞神經系統以及聽覺和前庭系統中也顯示出更高的轉導功效。
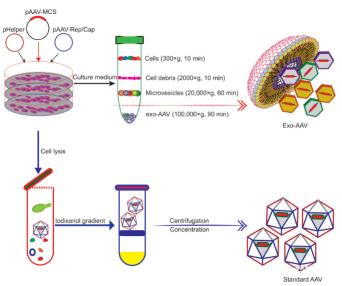
圖3、分別顯示生產和純化Exo-AAV(上部)和單獨AAV(下部)的不同程序示意圖
來源:本文來源網絡,版權歸相關權利人所有.
wyf
01.15




 齊岳微信公眾號
齊岳微信公眾號 官方微信
官方微信 庫存查詢
庫存查詢