**分子的羧基引入13C同位素標記,需要哪些反應步驟
把原料溶解在二甲基甲酰胺(DMF)中,然后放在13C標記的二氧化碳氣氛(13CO2,1個大氣壓)里,等幾個小時就搞定了!根據底物結構的不同,反應甚至在20 ℃下經過1小時就能以高收率獲得高純度的13C標記產物,甚至DMF溶液中有水也不要緊,只要別超過0.01 M就可以了。
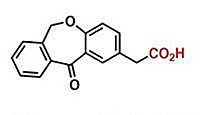
通常的辦法都包括:把原來的羧基脫除,再想辦法用13C標記的碳源引入一個羧基。有機化學家在這兩類反應上都做了大量的研究。盡管羧基在大多數條件下都相當穩定,但為了脫羧,前有入選有機化學教材的柯爾伯脫羧,后有近年來火熱的光氧化還原脫羧。而要引入羧基,則常常需要依賴強親核試劑或在電化學過程中原位形成等當量還原劑。反應條件上的巨大差異使得脫羧和羧化反應看似不可能在“一鍋”里完成。
但是,在自然界,脫羧反應和羧化反應卻一直是在“一鍋”里完成的。原則上,如果脫除羧基形成二氧化碳能和它的逆反應同時發生,形成一個化學平衡,那么原則上只要在反應體系中加入過量的13C標記二氧化碳,就能推動化學平衡向生成13C標記羧基的方向移動。
實際上,近年來已經有一些小組探索了簡單脂肪酸的可逆脫羧/羧化反應,但高溫(280 ℃-400 ℃)限制了它們的應用價值。在室溫或接近室溫的條件下實現這個過程依然是挑戰。
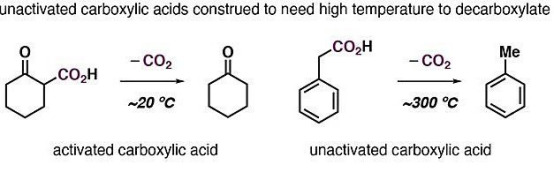
脂肪酸可逆脫羧/羧化反應的探索
在這項工作中,將4-氰基苯乙酸鉀(1)溶解在DMF中(濃度0.1 M),通入13 mL的13C標記二氧化碳(1個大氣壓,按當量算約6倍當量,此時二氧化碳在DMF中的濃度約0.2 M)。通過監控反應,發現在20 ℃下,同位素交換反應在15小時左右達到平衡,簡單的酸堿萃取即可以83%的收率獲得13C富集的產物。
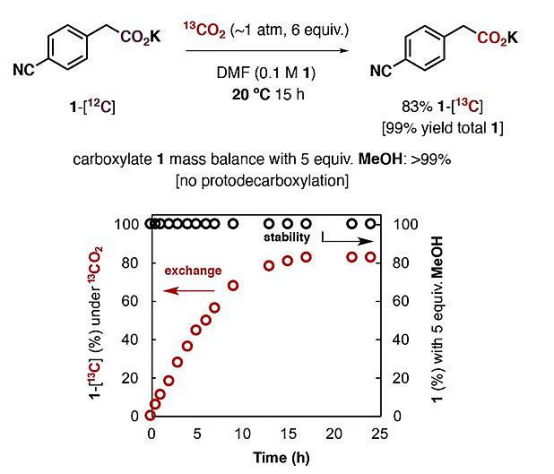
1的CO2交換(紅色)和MeOH質子化(黑色)的比較。
進一步的研究發現,實驗中羧酸鹽的抗衡陽離子和溶劑種類對反應有著重要影響。如果僅是羧酸,即4-氰基苯乙酸,升溫到70℃也沒有明顯反應;抗衡陽離子為鋰離子和鈉離子時雖然能反應,但速度較慢。介電常數大于30的極性非質子溶劑對反應是必要的,但體系中少量的水(低于0.01 M)以及甲醇也能被兼容。這些結果表明溶劑化的離子對能**促進反應進行。

反應條件研究。
在隨后的底物拓展研究中,研究人員發現,一系列包含相鄰芳基、羰基、氰基或磺酰基的羧酸鹽分子都可發生可逆的脫羧/羧化反應。標記產物的比例很大程度上取決于13CO2過量的程度(化學平衡)。實驗表明,產物中13C標記的比例可高達95%(13CO2 ~ 50 equivalents)。高轉化率,加上操作的簡便性,這是非常有競爭力的一種獲得13C標記羧酸的策略。簡便的操作也讓反應能夠兼容更多的基團,包括硼酸、各種鹵原子、醛、酮、酯、酰胺、磺酰基以及一些有反應活性的芳雜環。對眾多官能團的兼容性使得這一方法可以直接用于獲得多種13C標記的**分子以及氨基酸等重要的活性有機分子(下圖)。
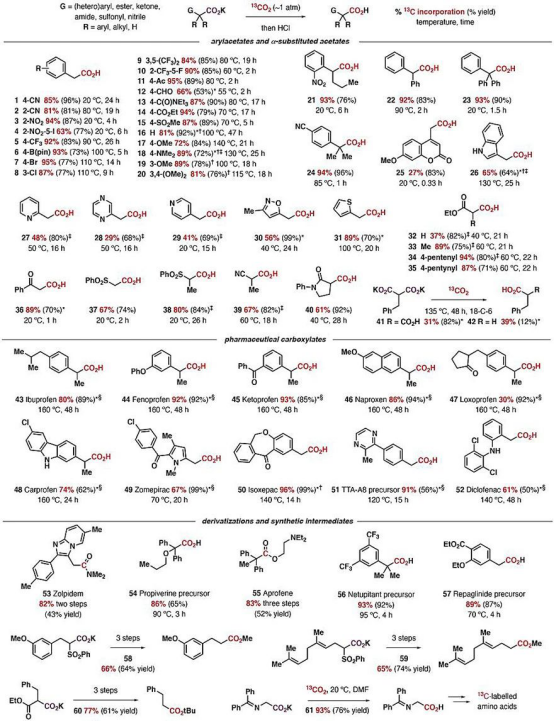
底物拓展及應用。
同位素標記技術的底物拓展中反應達到平衡所需的時間以及轉化率(先終標記產物的占比)與底物穩定陰離子的能力相關而與氧化還原能力關系不大,因此,他們猜測反應應該是通過直接脫羧或者形成烯醇式的過程實現的。這看似與反應對醛酮等官能團的兼容性相矛盾,但其實需要注意到,在體系中二氧化碳的濃度是相當高的(0.2 M),因此能優先與脫羧后形成的碳負離子反應。
實際上,在氮氣氣氛和弱布朗斯特酸存在條件下,確實會出現脫羧質子化,并且速率與布朗斯特酸的酸性成反比,表明布朗斯特酸捕獲脫羧中形成的二氧化碳是決速步驟。在氮氣氣氛下,實驗中還觀察到原料發生“歧化”反應,從表觀上看,一個原料分子的羧基與另一個原料分子上的α-H發生了交換。這表明,在實驗條件下,碳負離子確實有很強的捕獲二氧化碳的能力。但這種過程似乎是不可逆的。研究人員還注意到,在實驗條件下,α-H的H/D交換速率也得到**提升,可能的原因是形成了酸酐中間體,提升了α-H的酸性。
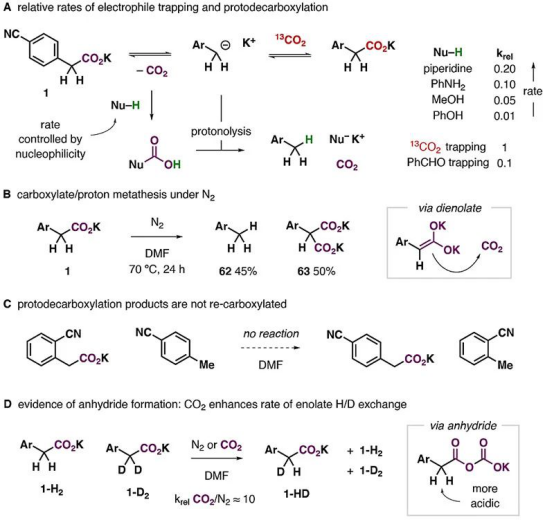
機理研究。
上述機理研究啟發研究人員利用這種溫和的脫羧反應生成的親核試劑和醛、酮等進行反應(氮氣氣氛下),通過形成C-C鍵構建一系列分子。
來源:本文來源網絡,版權歸相關權利人所有,如侵權,請聯系刪除




 齊岳微信公眾號
齊岳微信公眾號 官方微信
官方微信 庫存查詢
庫存查詢